肌肉生长抑制素3′UTR基因突变通过阻断 MSTN的翻译促进C2C12成肌细胞增殖和分化
肌肉生长抑制素(MSTN)的点突变可以产生特克塞尔羊的双肌肉表型。然而,其他物种是否具有与 MSTN 相同的作用方式,是否可以通过跨物种遗传编辑获得育种材料,目前尚不清楚。双荧光素酶报告系统证实,小鼠 MSTN 3′ UTR 突变可以为 mmu-miR-1/206创建一个 tar-get 位点。利用 CRISPR/Cas9基因编辑技术构建了 MSTN 3′ UTR 突变的 C2C12细胞模型。然后分析突变 C2C12细胞模型中 MSTN 的 mRNA 和蛋白表达。结果显示,突变阻断了 MSTN 的转运水平。通过抑制 mmu-mir-206,MSTN 蛋白在突变 C2C12细胞中的低表达可以得到修复。此外,通过 RT-PCR、 CCK8分析、 EDU (5- 乙炔基 -2′-脱氧尿嘧啶核苷)增殖分析、免疫荧光分析、 Western blot 和肌管融合统计等方法检测突变型 C2C12细胞模型的增殖和分化能力。本研究可作为阐明 MSTN 功能和分子机制的参考,为准确的育种改良奠定基础。

1. 背景介绍
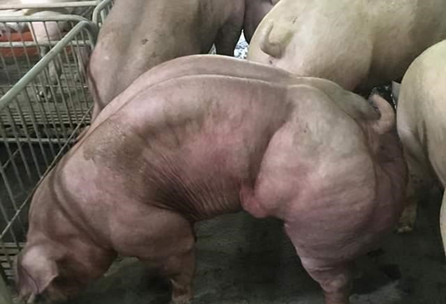

MSTN 是肌肉生长的负调节因子。MSTN 的缺失或失活增加了肌细胞的数量、肌纤维的直径和数量以及肌肉的过度发育。牛、羊、狗、老鼠和具有 MSTN 基因突变的个体都表现出“双重肌肉”特征。
在德克塞尔羊中,MSTN 3′UTR 的 g + 6723 G-A 突变为 miR-1和 miR-206的结合位点。它引起 MSTN 的传递性抑制,这在德克塞尔羊中表现出双重肌肉效应。但目前对 MSTN 功能的研究大多是基于 MSTN 的整体淘汰或敲除。利用 CRISPR/Cas9基因敲除绵羊基因组中的 MSTN 基因,获得了基因改造的绵羊,其产肉量显著提高。利用 CRISPR/Cas9和 Cre/LoxP 获得了不含选择标记的 MSTN 基因敲除猪。MSTN 基因敲除大鼠,山羊,狗和兔也已开发出来。以往对 MSTN 功能的研究主要集中在构建 MSTN 基因敲除的细胞或动物模型上。在这项研究中,改变了 MSTN 3′UTR 的四个连续碱基,导致 MSTN 表达减少。
2. 技术路线
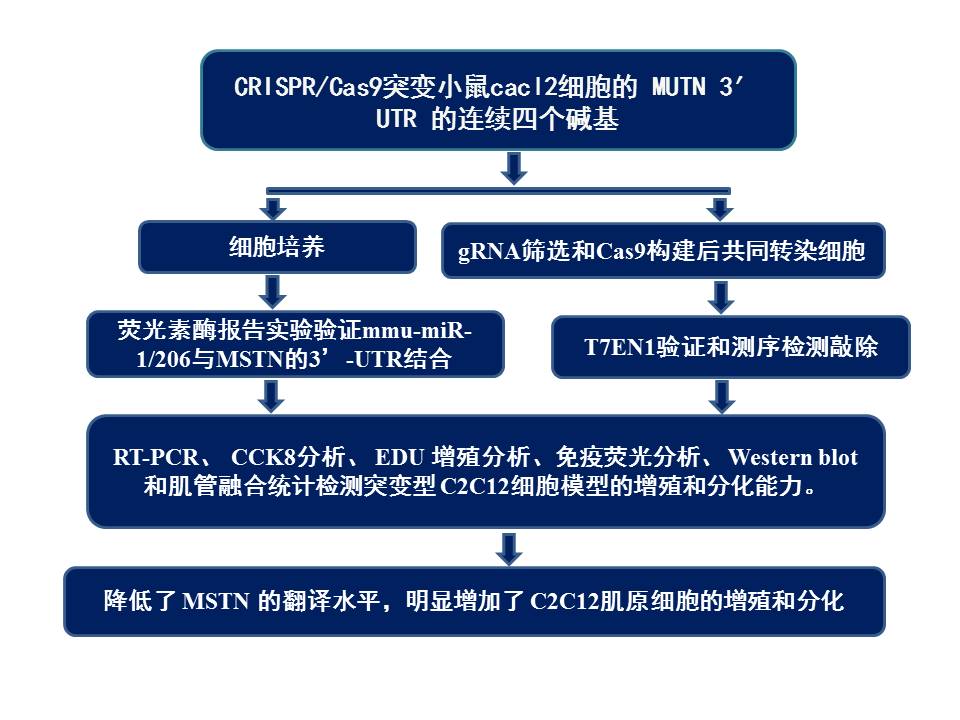
3. 实验结果
C2C12细胞 MSTN 3′ UTR 突变位点设计的突变位点为 mmu-miR-1和 mmu-miR-206创建了结合位点。
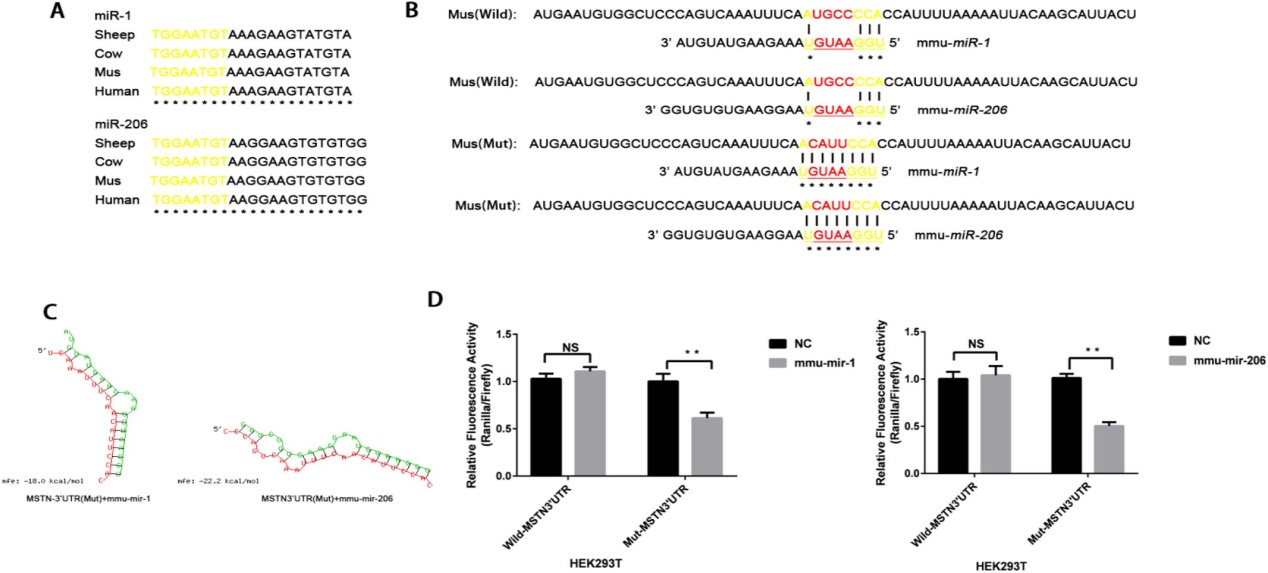
图一. 小鼠 MSTN 3′ UTR 基因 g + 6184-6187 TGCC-CATT 突变为 mmu-miR-1和 mmu-miR-206的结合位点。(a)成熟 miR-1和 miR-206的多种同源序列,miRNA 的种子区为黄色。比对序列之间的保守区域用星号表示。(b) g + 6184-6187 TGCC-CATT 突变对 C2C12细胞 MSTN 3′ UTR 中 mmu-miR-1和 mmu-miR-206碱基配对的影响。MSTN3′ UTR 的种子匹配序列为黄色,突变为红色。比对序列之间的保守区域用星号表示。(c) mmu-miR-1和 mmu-miR-206靶位预测及稳定性分析。Mfe 代表最小自由能。(d)将野生型 mstn3′ UTR-psiCHECK2和 Mut-MSTN3′ UTR-psiCHECK2与 NC (pCD513B-1)、 mmu-mir-1-pcdhh 和 mmu-mir-206-pcdhh 共转染 HEK293T 细胞,测定其荧光素酶活性。
最终获得了8个理想的阳性克隆。已经获得了预期的突变体 C2C12细胞模型。
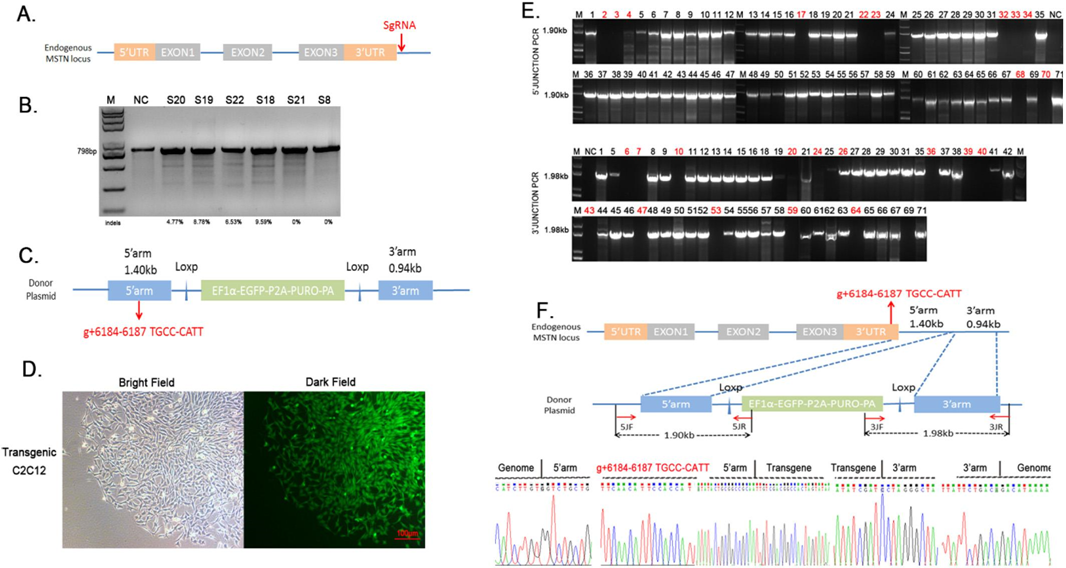
图二. CRISPR/Cas9介导的突变 C2C12细胞模型 (a)目标示意图。用红色箭头标记 sgRNA 的靶位点,位于 MSTN 3′ UTR 区域的下游。(b)采用 T7E1分析法检测不同 Cas9切割载体的切割效率。Fcut = (b + c)/(a + b + c).A 是未切割 DNA 带的灰度值,b 是从5′同源臂引入的。(d)突变型单克隆生长状态示意图(scale bar = 100μm)。(e)5′连接 PCR (1.90 kb)和3′连接 PCR (1.98 kb)证实了突变单克隆的精确整合。“ NC”代表野生型 C2C12。在单克隆抗体的 MSTN 3′ UTR 中发现了一个突变测序。突变序列是红色
RT-PCR 结果(图3A)表明,突变体中 MSTN 的相对 mRNA 表达与野生型无明显差异。免疫荧光(图3B,c)和免疫印迹(图3D,e)结果表明,突变体的 MSTN 蛋白表达明显低于野生型。这些结果表明,C2C12细胞 MSTN 3′ UTR 突变抑制了 MSTN 的转运水平。
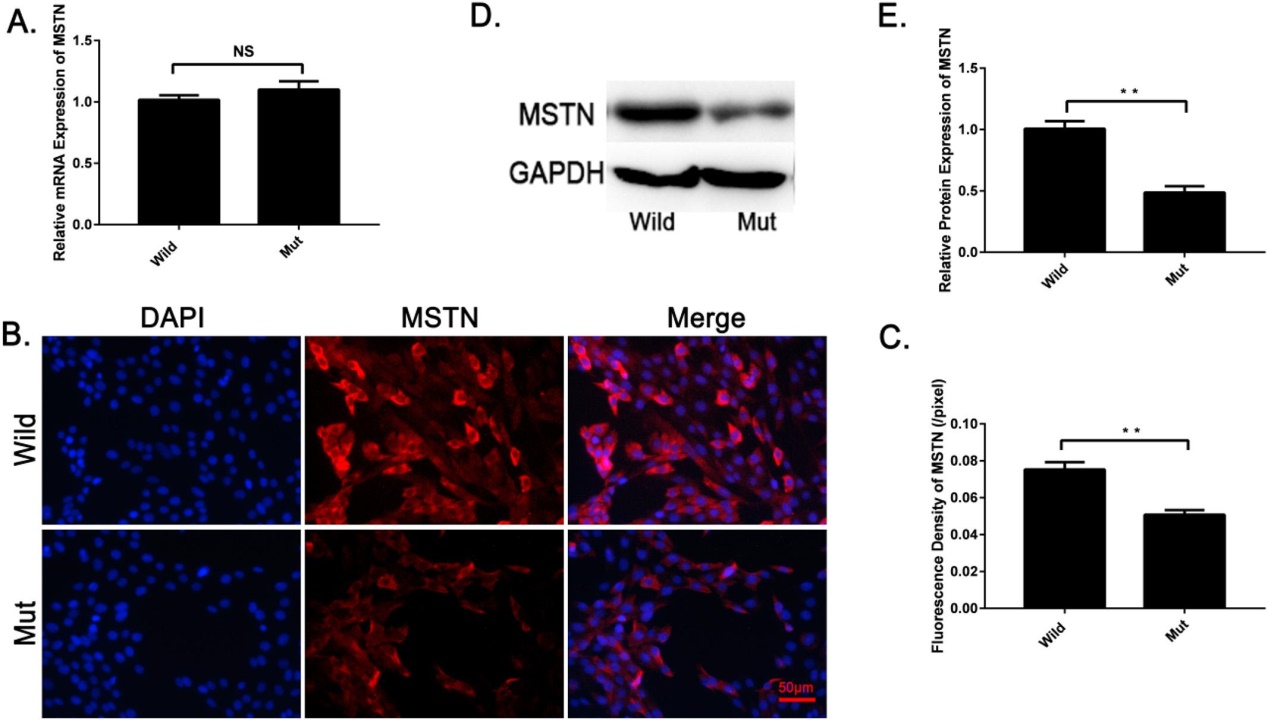
图3. MSTN 在 C2C12突变细胞模型中的表达分析。(a)野生型 C2C12小鼠成肌细胞与突变型 C2C12细胞 MSTN mRNA 表达的比较。MSTN mRNA 在突变型 C2C12细胞模型中的表达与野生型 C2C12无明显差异。野生型 C2C12小鼠成肌细胞和突变型 C2C12细胞 MSTN 蛋白表达的免疫荧光染色比较。MSTN 染色为红色,核染色为 DAPI (蓝色)。(c)用 IMAGEJ 软件(50μm 尺度条)分析 MSTN 的荧光强度。(d,e) Western blot 比较 MSTN 蛋白在野生型 C2C12小鼠成肌细胞和突变型 C2C12细胞中的表达。MSTN 蛋白在突变 C2C12细胞模型中的表达明显低于野生型 C2C12小鼠成肌细胞。
qRT-PCR 结果表明,该抑制剂能显著降低 mmu-miR-206的 mRNA 表达,模拟物及其前体表达载体能显著增加 mmu-miR-206的 mRNA 表达。
在突变的 C2C12细胞中,miR-206的抑制剂显著提高了 MSTN 的蛋白表达水平,而 miR-206的模拟物和表达载体则显著抑制 MSTN 的蛋白表达。这些结果表明,mmu-miR-206可抑制突变 C2C12细胞模型中 MSTN 的表达。
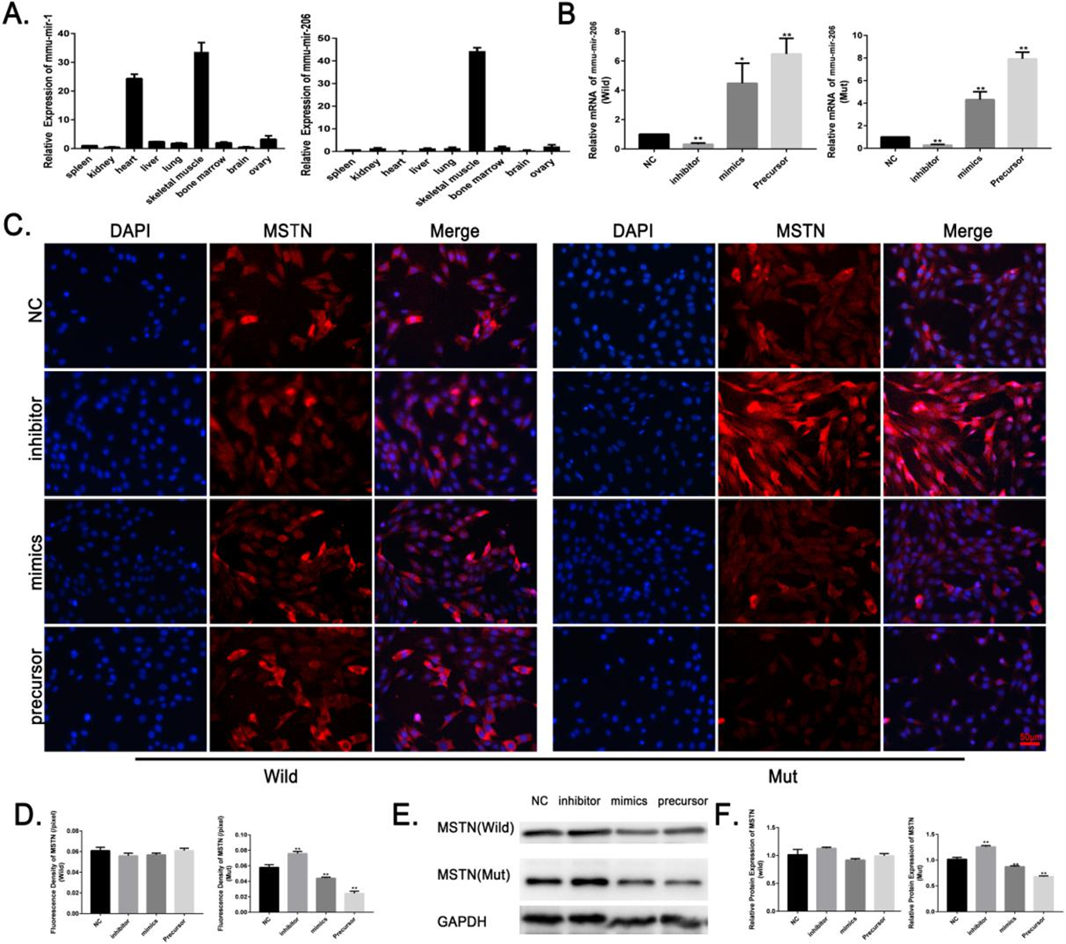
图4. Mmu-miR-206抑制突变 C2C12细胞模型中 MSTN 的表达。(a)定量方法检测不同组织中 miR-1和 miR-206的相对 mRNA 表达。miR-1在小鼠骨骼肌和心肌中高表达,而 miR-206在骨骼肌中特异表达。(b)用 NC、抑制剂、模拟物和前体表达载体转染野生型和突变型 C2C12细胞36h 后,检测 miR-206的相对 mRNA 表达水平。(c)将 miR-206的 NC、抑制剂、模拟物和前体表达载体转染野生型和突变型 C2C12细胞36h 后,用免疫荧光染色法(scale bar = 50μm)检测 MSTN 的相关蛋白表达。(d)用 IMAGEJ 软件对 MSTN 的荧光强度进行分析。(e,f)免疫印迹法检测 MSTN 的相对蛋白表达。miR-206的抑制剂能显著增加 MSTN 的蛋白表达,而 mmu-miR-206的前体表达载体和模拟物能显著抑制 MSTN 的蛋白表达。
细胞增殖基因CDK2和 Cy-clinD1的 mRNA 表达水平显著升高,而 P21的 mRNA 表达水平显著降低。Cck8细胞增殖实验结果(图5B)表明,突变体的增殖能力明显高于野生型。细胞增殖实验(图5C,d)显示,突变型 C2C12细胞中的 EDU 细胞百分比明显高于野生型。这些结果表明 MSTN 3′ UTR 突变促进了 C2C12细胞的增殖能力。
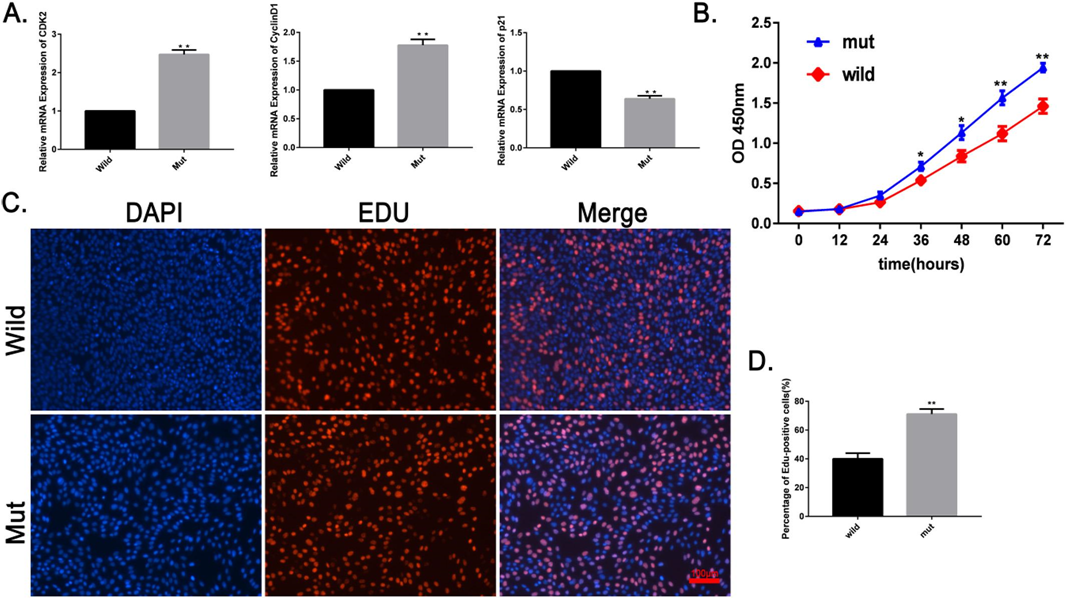
图5. 突变型 C2C12细胞模型的增殖分析。(a) RT-PCR 检测细胞增殖相关基因(cyclin D1、 CDK2、 P21) mRNA 表达水平的变化。用 CCK8细胞增殖实验分析突变型 C2C12细胞模型增殖的变化。突变型 C2C12细胞模型24h 后增殖能力明显高于野生型 C2C12(* pb0.05)。(c)用 EDU 染色法检测突变型 C2C12细胞模型的增殖能力。EDU 染色呈红色,细胞核染色用 DAPI 染色(蓝色。(d)用 IMAGEJ 软件 edu 阳性细胞百分比。
肌源性调节因子的相对 mRNA 表达,突变型中 MYOD、 MYOG 和 MYHC 的相对 mRNA 表达水平显著增加(图6A)。免疫荧光的结果表明突变体的 MYOG 蛋白表达水平明显高于野生型。在分化培养5天后,用免疫荧光法检测融合指数。突变体中 MYHC 蛋白表达水平显著高于野生型(图6E)。突变细胞的融合指数明显高于野生型(图6F)。这些结果表明,MSTN 3′ UTR 突变促进了 C2C12细胞的分化能力.
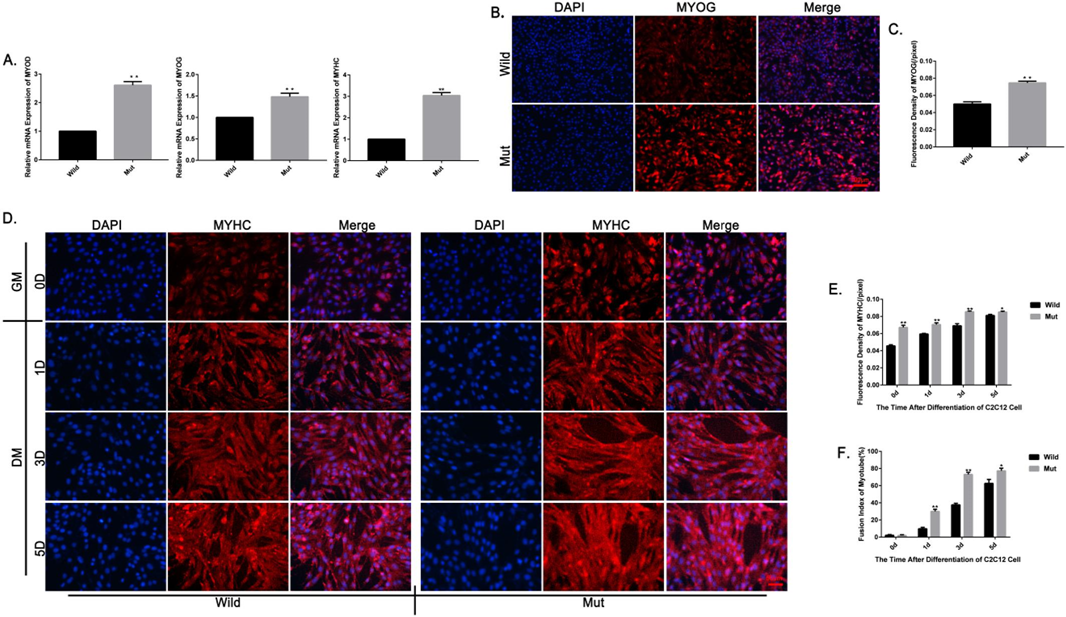
图6. 突变型 C2C12细胞模型的分化分析。(a) RT-PCR 检测细胞分化相关基因(MYOD、 MYOG、 MYHC) mRNA 表达水平的变化。(b) MYOG 蛋白的表达用免疫荧光法检测。MYOG 染色呈红色,细胞核用 DAPI (蓝色)染色(100μm)。(c)用 IMAGEJ 软件分析 MYOG 的荧光密度。(d)比较野生型 C2C12小鼠成肌细胞模型和突变型 C2C12细胞模型的肌管数目,并进行免疫荧光染色。MYHC 染色呈红色,细胞核用 DAPI (蓝色)染色(标准杆 = 50μm)。(e)用 IMAGEJ 软件分析 MYHC 的荧光强度。(f)分化培养5天后,突变型 C2C12细胞模型的融合指数明显高于野生型 C2C12成肌细胞模型。
4. 总结
结论: 成功地构建了一个 MSTN 突变的 C2C12细胞模型。Mmu-mir-206对 MSTN 表达有抑制作用。
创新点:本研究利用 CRISPR/Cas9技术对肌肉生长抑制素(MSTN)3′UTR 区的4个连续碱基进行编辑,改变了 MSTN 的表达和 C2C12的增殖分化能力。
意义:本研究可作为阐明 MSTN 功能和分子机制的参考,为准确的育种改良奠定基础。
文章链接:https://www.sciencedirect.com/science/article/pii/S0141813020303639

